近年来,随生物制药行业上游细胞培养工艺更迭,用于表达目的产品的细胞密度越来越高,从而细胞发酵液中的杂质含量(如细胞碎片、HCP、HCD等)也越来越高。其中最为突出的问题是细胞收获液中的杂质较多,对后续层析工艺提出更高的要求。面对该工艺问题,科百特推出较常规深层滤器有更高的杂质去除能力的深层过滤产品,以下是对该系列产品去除HCP/HCD的介绍及案例。
HCP、HCD概念及要求
宿主细胞残留蛋白HCP(Host cell protein)
是指生物制品生产过程中所使用细胞系产生的蛋白成分,是具有多种生理化学和免疫学特性的复杂混合物,且为工艺相关的主要杂质。
因HCP中有很多成分参与宿主细胞的蛋白质合成,其残留会在生物制品给药过程中存在潜在的免疫原性,引发患者严重的免疫反应。特别是在单克隆抗体药物和基因治疗药物的生产中,HCP残留是宿主细胞在生产过程中产生的非目标蛋白,这些残留蛋白可能会引发机体的免疫应答,影响生物制品的安全性和有效性。
除安全问题外,HCPs的存在也会影响产品质量,如引发治疗性蛋白质的聚集、片段化、制剂成分的降解等,导致蛋白质药物的稳定性受影响。
因此,对HCP残留的检测和控制是生物制品质量控制的关键环节。在2020版中国药典三部各论中表示,HCP标准为占总蛋白含量要小于0.05%。FDA规定,需要用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm)。
宿主细胞残留核酸HCD(Host Cell Residual DNA)
是指经细胞培养表达和纯化的蛋白类药物中,残留的微量核酸(宿主基因组、质粒或总 DNA),其来源包括宿主细胞的基因组和质粒。由于宿主细胞残留 DNA 可能会传递肿瘤或病毒相关基因,因此有潜在危险性。
《中国药典》三部(2010版)规定,以哺乳细胞基质生产的生物制剂DNA残留量不能超过100 pg/剂,以细菌或真菌为细胞基质生产的疫苗DNA残留量不能超过10 ng/剂。
HCP、HCD去除方法
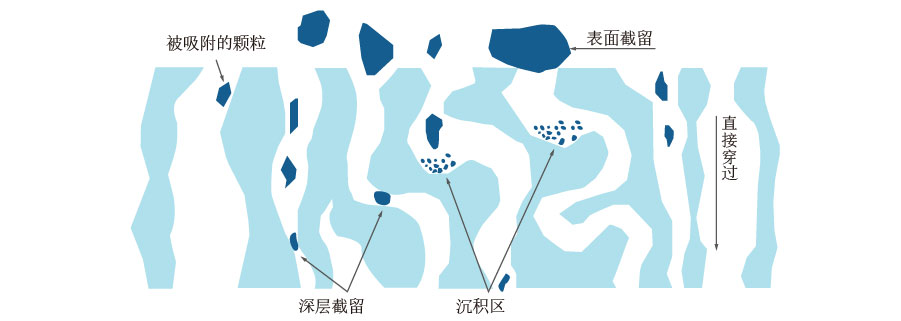
生物制品生产过程中一般通过下列纯化步骤来降低HCP、HCD水平:深层过滤、亲和层析、离子交换层析、混合层析等。其中深层过滤是通过静电吸附、疏水作用、氢键和分子间相互作用力等原理来去除HCP,HCD和HCP一样,也能够被深层滤器通过吸附作用来去除。
科百特深层过滤新品
科百特深层过滤产品以纤维素纤维作为骨架,硅藻土等助滤剂作为过滤介质,新品则在原有离子型粘合剂的基础上进行优化,使其对于细小杂质的吸附效果更加明显,而对于产品的收率基本没有影响。

其中H6HPPC在原有正电荷吸附机理上继续增强正电荷吸附效果,H4HPPC除了增强原有正电荷吸附效果外,还增加负电荷吸附效果,对于某些带正电HCP有很好的控制效果。
科百特迭代深层滤器优势及案例分享
更高的杂质去除能力
① 案例I
物料信息:
CHO细胞发酵液,活细胞密度18×106 cells/ml,活率83%,滤前浊度>3300NTU;
过滤信息:
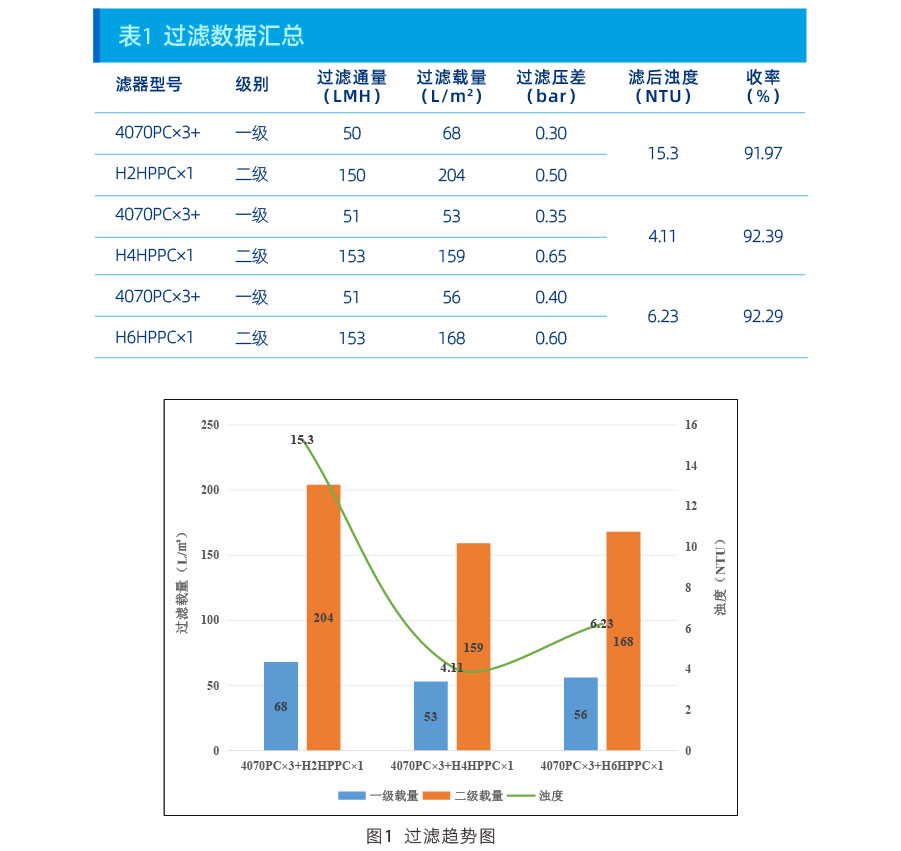
杂质去除数据:
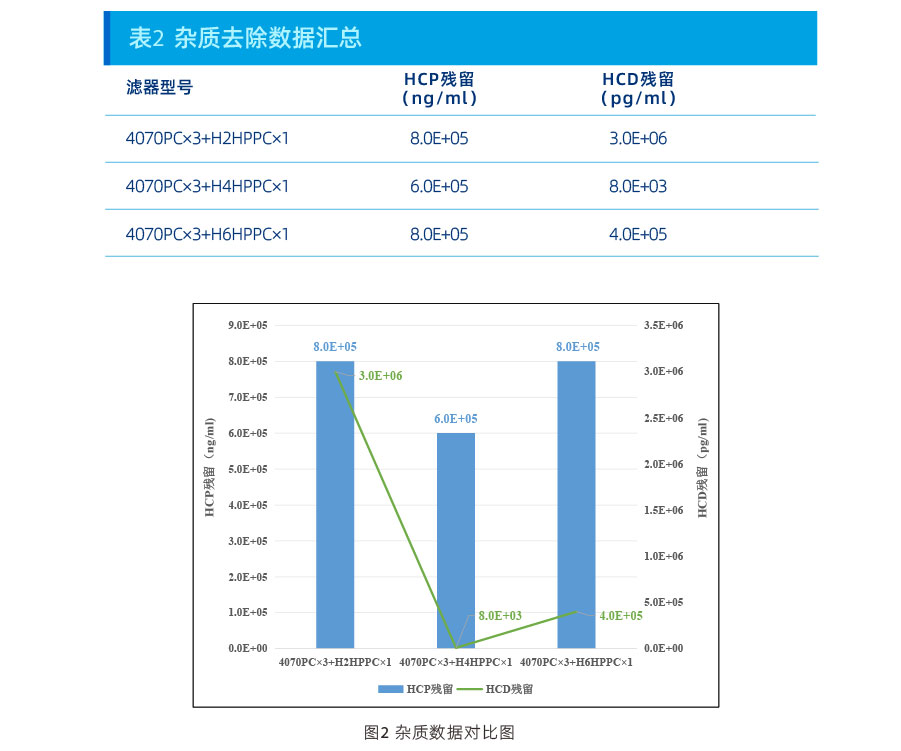
结果:
从上述数据可以看出,在本项目上:
浊度控制能力:H4HPPC>H6HPPC>H2HPPC;
HCP去除能力:H4HPPC>H6HPPC=H2HPPC;
HCD去除能力:H4HPPC>H6HPPC>H2HPPC。
② 案例II
物料信息:
CHO细胞发酵液,活细胞密度6.4×106 cells/ml,活率81%,离心处理,滤前浊度158NTU;
过滤信息:
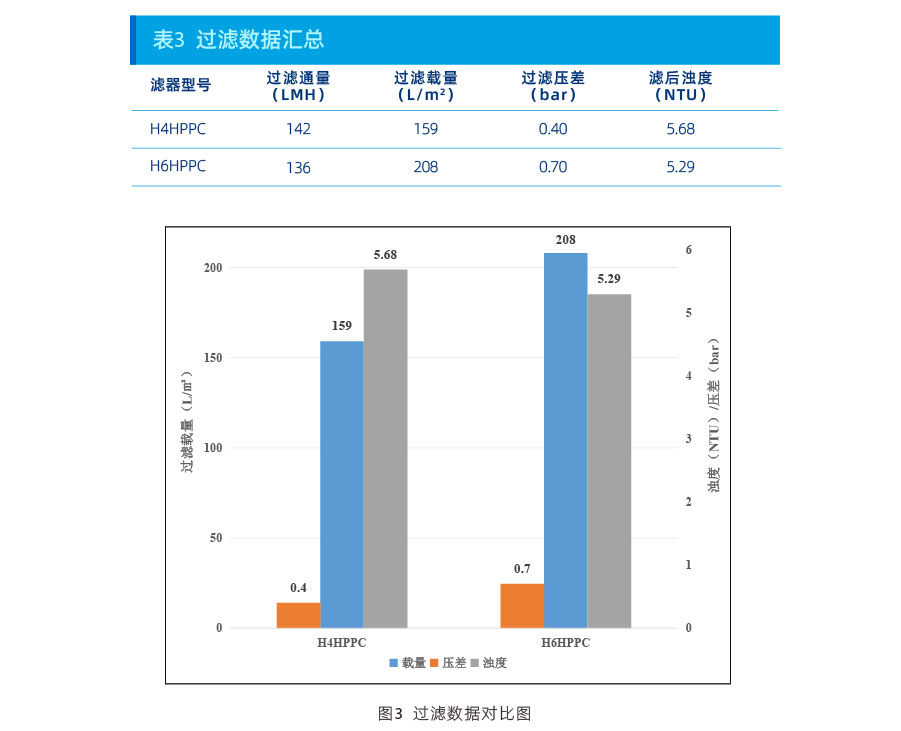
杂质去除数据:
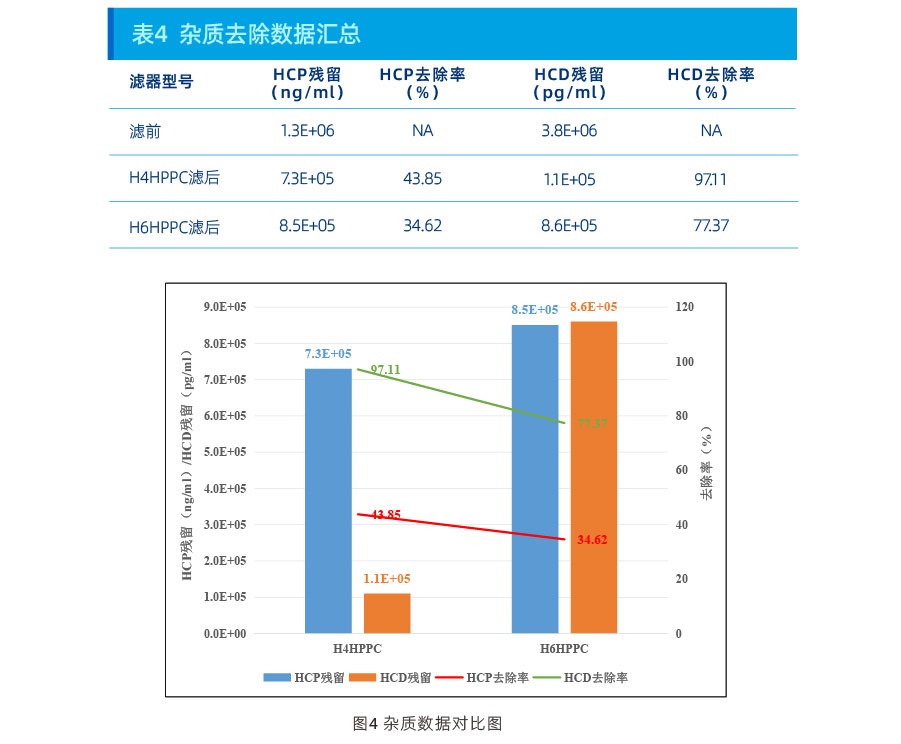
结果:
从上述数据可以看出,在本项目上:
浊度控制能力:H6HPPC>H4HPPC;
HCP去除能力:H4HPPC>H6HPPC;
HCD去除能力:H4HPPC>H6HPPC。
③ 案例III
物料信息:
CHO细胞,Low pH&中和处理,滤前浊度12.2NTU;
过滤信息:
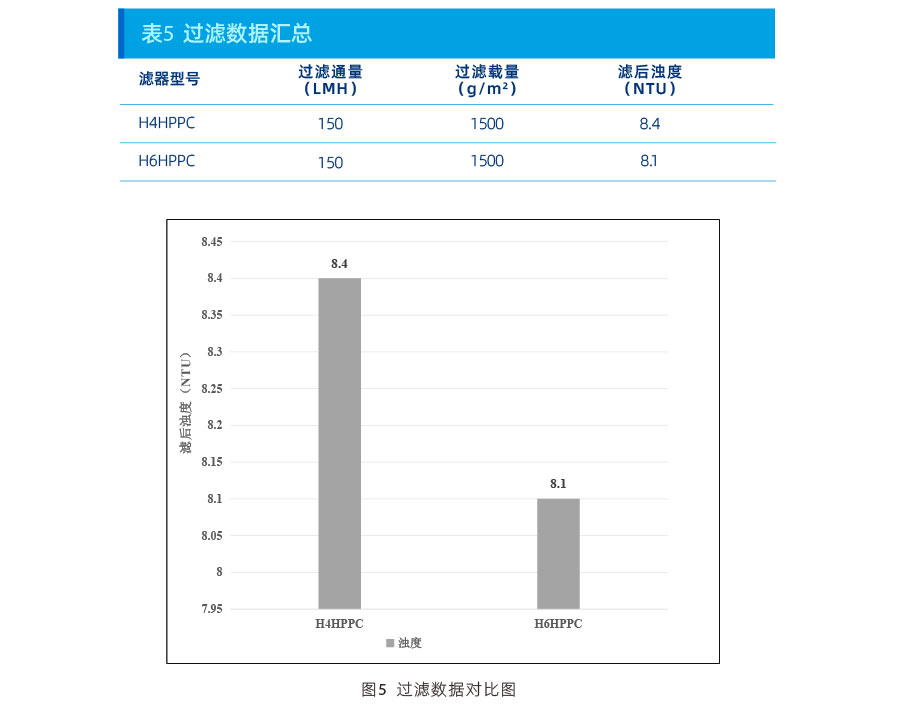
杂质去除数据:
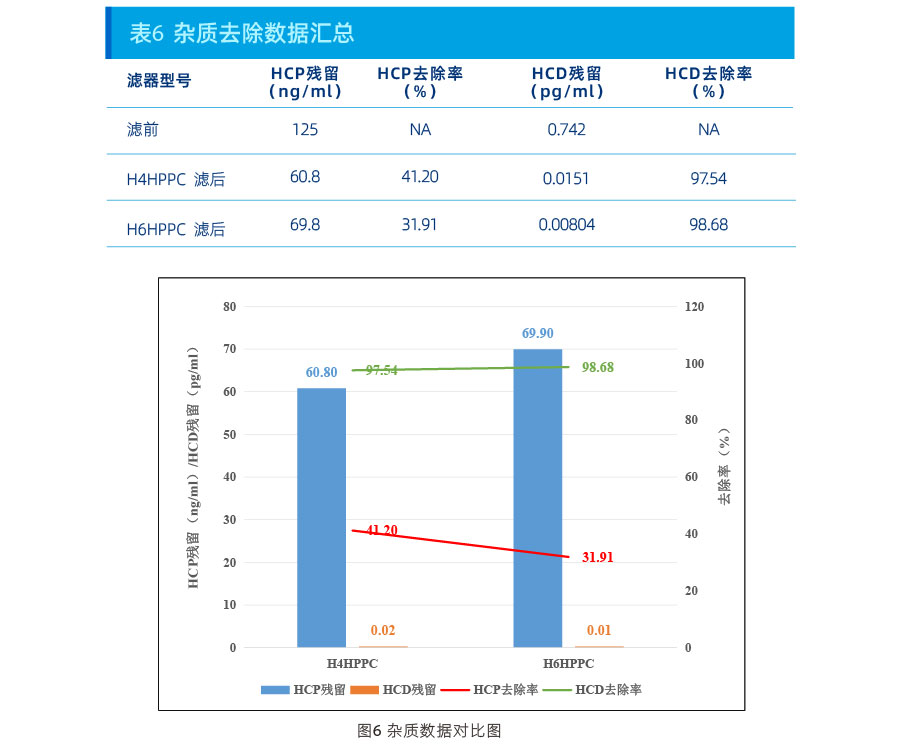
结果:
从上述数据可以看出,在本项目上:
浊度控制能力:H6HPPC>H4HPPC;
HCP去除能力:H4HPPC>H6HPPC;
HCD去除能力:H6HPPC>H4HPPC。
科百特深层过滤迭代产品H4HPPC、H6HPPC在浊度控制、杂质去除上,表现优于常规深层滤器H2HPPC,但是在载量上相对H2HPPC偏低,后续用户若对于浊度控制、杂质去除有较高的要求,可选择H4HPPC、H6HPPC进行测试。




