近年来,内毒素去除问题已然成为生物制药生产工艺中的热点话题。其中,物料高倍数浓缩洗滤后内毒素仍存在超标的问题成为生物制药工作者关注的焦点。
内毒素 简介
内毒素(Endotoxin)是一种脂多糖(LPS),其单位为EU。它是革兰氏阴性细菌细胞壁外膜的外部脂质主要组成部分,当细胞死亡或分解时将被释放出来。当内毒素进入血液或CSF(脑脊液)时会引起发热,因此也被称为热原。相关法规规定,在药品、注射用生物制剂和一些组织培养培养基的生产过程中必须采取去除措施。
如何有效去除内毒素?
由于内毒素中含有带负电荷的磷酸基和羧基,其单体等电点在2左右,相对较低,即在pH>2的溶液中内毒素表现出电负性,所以离子交换层析法是蛋白质常用的去热原法之一。
但传统填料的层析方法存在缺点,这也限制了它应用在除内毒素步骤。其中包括如填料的湍流、操作繁琐、流速低、再生时间长和有限的化学稳定性等操作和使用上的问题。而低流速和对污垢的敏感性则意味着将层析填料纳入大规模生产的纯化步骤中是麻烦且昂贵的。
针对这一棘手问题,科百特经研发创新,推出了高容量、可扩展和即用型的Purcise™ Q强离子交换吸附膜技术。该吸附膜具有流速快、载量大、操作简单等优点,可满足用户在实验室研发及放大生产工艺规模中除内毒素的需求。

科百特应用案例
我们发现,在使用10KD膜包进行蛋白浓缩的应用中,样品和洗滤Buffer中的内毒素会随着浓缩洗滤的进行逐渐富集。且在浓缩过程中内毒素会增大与蛋白的吸附,导致其最终难以去除。
Cobetter基于上述情况立即展开内部研究,提供了一个新的内毒素去除思路,即建议在样品浓缩前,分别对样品和换液Buffer使用Purcise™ Q膜吸附器进行内毒素预处理,从工艺源头对内毒素进行控制,从而保证浓缩换液后内毒素残留在合格的范围。
研究背景
根据市场调研及反馈,目前蛋白高倍浓缩制剂存在内毒素超标或接近检测限值的情况,具体表现为:使用10KD膜包采取先浓缩、洗滤再浓缩的方式得到最终原液后,原液内毒素残留接近质量限值或多批次高于质量标准限值。并且部分项目采取使用Purcise™ Q膜吸附器直接对浓缩后原液进行内毒素去除措施表现为无内毒去除效果。
经科百特研发应用团队初步分析,该现象是因为高浓度蛋白与内毒素吸附使其电荷分布发生改变,最终导致电荷吸附内毒素失败。
基于以上情况我们进行了深入测试研究:
实验一:测试Buffer条件的影响
按蛋白料液Buffer中相同成分(组氨酸、甘露糖、吐温体系)配置内毒素挑战液,由于Buffer中含有表面活性剂吐温成份,实验也单独考察了吐温对Purcise™ Q膜吸附器对去除内毒素的影响。
- 配置挑战buffer 1:UF/DF Buffer(去除吐温成分)加入标准内毒素原液,配置成终浓度为3 EU/ml的挑战液
- 配置挑战buffer 2:UF/DF Buffer(含吐温成分)加入标准内毒素原液,配置成终浓度为3 EU/ml的挑战液
两种挑战Buffer均使用0.9 ml Purcise™ Q针头式膜吸附器以9 ml/min流速进行过滤,过滤体积:90 ml,测试结果如下:
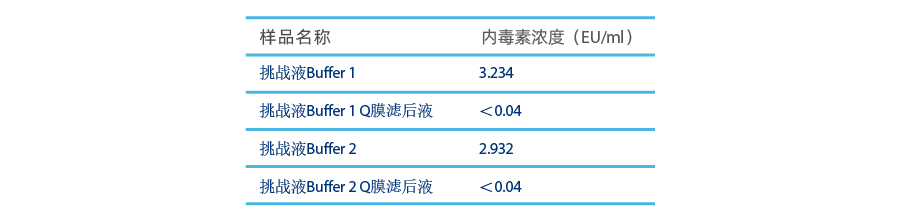
测试结果可得Buffer成分对Purcise™ Q膜吸附器除内毒性能无影响。
实验二:Buffer中痕量内毒素的影响
使用10KD膜包直接对制剂Buffer(组氨酸、甘露糖、吐温体系)进行浓缩,检测浓缩后Buffer中内毒素的残留。
配置4L UF/DF换液Buffer,一分为二(内毒素<0.02 EU/ml):
- 实验组:2L Buffer经过5 ml Purcise™ Q膜吸附器膜以10 MV/min过滤(过滤1L和2L时取瞬时样检测内毒素残留),得到滤后液,对滤后液进行超滤浓缩,分别在10、40倍浓缩时取样检测内毒素残留
- 对照组:2L Buffer直接进行超滤浓缩,分别在10、40倍浓缩时取样检测内毒素残留
检测结果如下
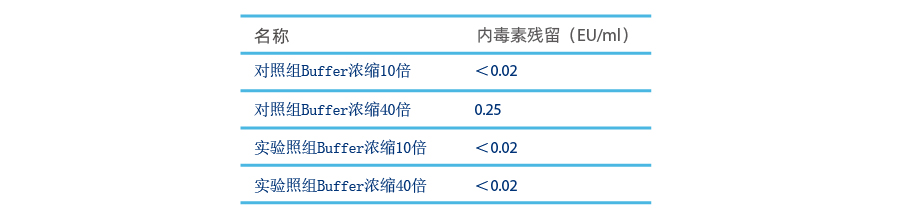
从对比实验可以看出,在Buffer采用药用级物料且配置溶液满足质量要求的情况下,痕量内毒素仍会在浓缩工艺过程中逐渐富集,从而影响最终产品质量。特别是在高倍浓缩工艺中,内毒素超标风险会急剧上升。而使用Purcise™ Q膜吸附器处理后,能有效控制Buffer中痕量内毒素,以减小浓缩过程中内毒素超标风险。
实验三:超滤前料液内毒素控制
在浓缩前将蛋白样品和换液制剂Buffer(组氨酸、甘露糖、吐温体系)分别经过Purcise™ Q膜吸附器进行除内毒控制,再进行超滤换液,得到最终原液。
样品准备:
1. 蛋白样品前处理:使用0.9 ml Purcise™ Q针头式膜吸附器按流速4.5 ml/min对1L蛋白样品(浓度:~ 8.0 g/L)进行过滤,去除到蛋白样品中游离内毒素,滤后内毒残留:<0.05 EU/ml;
2. UF/DF buffer准备:使用5 ml Purcise™ Q膜吸附器按流速50 ml/min(5 MV/min)对5L制剂Buffer进行过滤,去除Buffer中痕量内毒素,滤后内毒残留:<0.02 EU/ml。
蛋白浓缩洗滤再浓缩:
将1L蛋白料液浓缩5倍后使用UF/DF Buffer进行8倍换液,换液完成后再进行3倍浓缩,等到最终原液。其中对换液后第二步浓缩过程进行分段取瞬时样检测内毒素残留。
实验结果如下

*本次实验对照组:蛋白直接采用先浓缩再洗滤再浓缩的方式得到最终原液。经检测原液内毒残留>1 EU/ml。
实验结果可得,使用Purcise™ Q膜吸附器从源头对UF/DF工艺进行内毒素控制后,最终原液内毒素可控制在0.5 EU/ml以内,相比于控制前内毒素残留有明显下降。该方案在提高产品质量的同时也降低了工艺过程内毒素污染的风险。
因此,在高倍浓缩换液工艺中,建议在样品浓缩前分别对样品和换液Buffer使用Purcise™ Q膜吸附器进行内毒素吸附预处理,从工艺源头对内毒素进行控制,来保证最终浓缩换液后内毒素残留在合格的范围。




